Znanstvenice in znanstveniki do novega načina prepoznavanja bioloških molekul

Suwannar Kawila/Canva
Datum objave:
Za normalen potek vseh življenjskih procesov potrebujemo sodelovanje več biomolekul, na primer različnih proteinov, molekule DNA itd. Pomembno je, da točno določene molekule tvorijo medsebojne 'stike' in tako izvedejo določen biološki proces. A na kakšen način različne molekule "vedo", katera se mora srečati s katero?
Gre za t. i. problem molekulskega prepoznavanja, ki ima že dolgo zgodovino. Na začetku 20. stoletja ga je opredelil nemški kemik in Nobelov nagrajenec Emil Fischer. Predpostavil je, da imajo molekule točno določene oblike in zato se lahko prepoznata samo molekuli, ki imata komplementarno obliko, kot na primer ključ in ključavnica. Čeprav v tistem času Fischer ni vedel, kako točno so molekule videti oz. kakšne so njihove oblike, je bila hipoteza pravilna in v veliko primerih molekulsko prepoznavanje poteka po analogiji ključ-ključavnica.
V zadnjem času se je izkazalo, da velik del proteinov nima definirane oblike oz. imajo fluidno, spreminjajočo obliko (t. i. intrinzično nestrukturirani proteini). Kako v takem primeru poteka prepoznavanje molekul, saj analogija ključ-ključavnica temelji na jasni, fiksni obliki molekule?
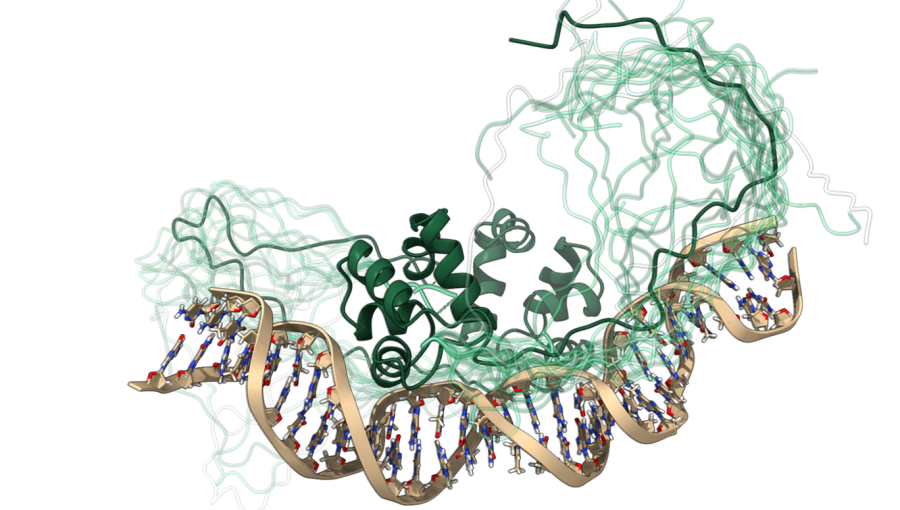
Raziskovalci doc. dr. San Hadži, Zala Živič, Uroš Zavrtanik in prof. dr. Jurij Lah s Katedre za fizikalno kemijo Fakultete za kemijo in kemijsko tehnologijo Univerze v Ljubljani so skupaj s kolegi s Kemijskega inštituta in Univerze v Bruslju (VUB) objavili članek v reviji Nature Communications z naslovom "Mehko prepoznavanje DNA s transkripcijskim dejavnikom HigA2 iz Vibrio cholerae (Fuzzy recognition by the prokaryotic transcription factor HigA2 from Vibrio cholerae)". V raziskavi so avtorji pojasnili, na kakšen način poteka prepoznavanje med proteinom s fluidno, spreminjajočo se strukturo in molekulo DNA. Uredniki revije Nature Communications so raziskavo posebej izpostavili v rubriki Editors’ Highlights.
V raziskavi so avtorji preučili vezavo bakterijskega proteina HigA2 na DNA. Ugotovili so, da je pri tem ključno sodelovanje med globularno DNA-vezavno domeno proteina in njegovo intrinzično neurejeno regijo, ki interagira z DNA na »fuzzy« način. Z uporabo metod jedrske magnetne resonance (NMR), ozkokotnega sipanja rentgenskih žarkov (SAXS), izotermne titracijske kalorimetrije (ITC) in mutageneze so natančno opredelili biofizikalne in strukturne značilnosti tovrstne mehke interakcije in ugotovili, da nestrukturirana regija lebdi nad DNA in tvori prehodne stike preko specifičnih aminokislinskih »otokov«. Za razliko od doslej opisanih mehkih interakcij v literaturi je v tem primeru opaziti višjo stopnjo sekvenčne specifičnosti.
Zanimivo, da isto zaporedje aminokislin na proteinu HigA2 lahko vzpostavi povsem drugačen način interakcije, kadar se veže na proteinsko tarčo. V tem primeru vezanje poteka preko močnih, specifičnih interakcij in je sklopljeno z zvitjem zaporedja v vijačnico (vezava »induced fit«). Opisani primer kaže, kako lahko nestrukturirano aminokislinsko zaporedje omogoča različne načine molekulskega prepoznavanja, in tako opravlja več bioloških nalog.
Raziskavo je sofinancirala Javna agencija za znanstvenoraziskovalno in inovacijsko dejavnost Republike Slovenije preko programske skupine Fizikalna kemija P1-0201 (M. Lukšič) in projekta J1-50026 (S. Hadži). Članek je objavljen v odprtem dostopu: https://www.nature.com/articles/s41467-024-47296-3.